Depuis l'apparition de l'épidémie liée au Covid-19, l'UPGCS a publié plusieurs articles afin que ses lecteurs comprennent mieux cette affection et pour centraliser les différentes publications scientifiques sur ce sujet.
Mieux le comprendre pour mieux lui résister !
L'orage de cytokine et le rôle éventuel des traitements anti-hypertenseurs posent débat dans les Sociétés Savantes.
Cet article se propose donc de faire le point des observations conjointes du Docteur Mohamed Boutbaoucht, médecin expert auprès de notre association et d'Elise Carboullec, rédactrice scientifique pour l'UPGCS.
L’association entre la mortalité ou la morbidité liée au Covid-19 et l’hypertension artérielle a retenu l’attention à la lueur de plusieurs études épidémiologiques réalisées en Chine au début de l’épidémie. Aucune d’entre elles n’a procédé aux ajustements statistiques qui auraient permis d’y voir plus clair en évacuant les nombreux facteurs de confusion potentiels.
La question s’est rapidement posée sur l’éventualité d’un lien entre certains antihypertenseurs et le risque précédemment évoqué.
Les traitements anti-hypertenseurs et l'infection Covid 19
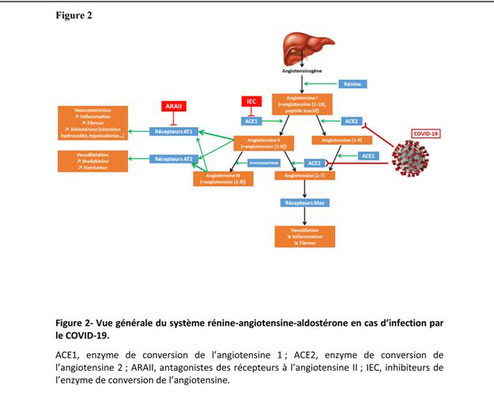
Physiologie du système rénine angiotensine aldostérone ( figure 1)
LE SYSTÈME RÉNINE-ANGIOTENSINE-ALDOSTÉRONE : désigne un système hormonal localisé dans le rein et dont le rôle est de maintenir l’homéostasie hydrosodée.
1- Le système rénine angiotensine (Figure 1) est considéré comme un système hormonal : la rénine circulante provenant des cellules juxta-glomérulaires rénales agit sur l’angiotensinogène produit par le foie pour produire de l’angiotensine I.
Cette angiotensine I est convertie à son tour en angiotensine II par l’enzyme de conversion de l’angiotensine endothéliale. L’angiotensine II est alors distribuée dans les organes via le courant sanguin et induit des réponses physiologiques. Ce système (système extrinsèque) est responsable des principales réponses physiologiques. Il existe cependant également un système tissulaire (système intrinsèque) indépendant de l’enzyme de conversion de l’angiotensine circulante, responsable d’effets physiologiques tissulaires (effets sur les fonctions cardiaque, vasculaire et rénale).
2- L’enzyme de conversion de l’angiotensine (ECA) est une glycoprotéine comportant deux domaines homologues avec chacun un site catalytique. L’ECA est présente principalement sur la surface membranaire des cellules endothéliales, en particulier du lit vasculaire pulmonaire, mais peut être retrouvée dans le plasma. Il s’agit d’une enzyme non spécifique, dont les substrats principaux sont l’angiotensine I et la bradykinine.
Certains tissus contiennent des enzymes permettant la conversion d’angiotensinogène en angiotensine (protéases non rénine), directement en angiotensine II (cathepsine G, tonine), ou permettant la conversion non ACE dépendante d’angiotensine I en angiotensine II (cathepsine G, chymases). Il est en particulier mis en évidence que dans le cœur et le rein, les chymases contribuent à la conversion de l’angiotensine I en angiotensine II
3- Les récepteurs de l’angiotensine. Les effets de l’angiotensine II s’exercent sur des récepteurs transmembranaires couplés à des protéines G. Les deux sous-types de récepteurs sont les récepteurs AT1 et AT2. Ces deux récepteurs ont peu d’homologie de séquence.La plupart des effets physiologique de l’angiotensine II est médiée par la stimulation des récepteurs AT1.
Le rôle fonctionnel des récepteurs AT2, considérés parfois comme des récepteurs cardioprotecteurs, est moindre, consistant en un effet antiproliférant, proapoptotique, vasodilatateur et antihypertenseur.
4 Effets physiologiques
L’effet principal du système rénine-angiotensine est d’assurer la régulation à court et long terme de la pression - artérielle. L’angiotensine II a un effet vasoconstricteur très puissant . De plus, elle est responsable d’une hypertrophie vasculaire et cardiaque, et d’une augmentation de la synthèse et du dépôt de collagène.
Les mécanismes responsables de l’augmentation des résistances artérielles périphériques induite par l’angiotensine II sont :
- a. Une vasoconstriction directe, générale, mais plus puissante au niveau rénal
- b. Une augmentation de la neurotransmission adrénergique.
- c. Une augmentation des décharges sympathiques liée à un effet direct sur le système nerveux central
- d. Une libération d’adrénaline par la médullosurrénale.
L’angiotensine II a pour effet rénal de diminuer l’excrétion urinaire de Na+ et d’augmenter l’excrétion urinaire de K+.
Les mécanismes responsables de la modification des fonctions rénales par l’angiotensine
5- Les médicaments du système Rénine Angiotensine classés en trois catégories, on en citera que deux qui nous intéressent ici : .
- Les inhibiteurs de l’enzyme de conversion de l’angiotensine (IEC). dont deux actions :
1- Ils inhibent la conversion de l’angiotensine I en angiotensine II. Leur effet est donc d’inhiber les effets liés à la synthèse d’angiotensine II.
2- Ils augmentent les concentrations de bradykinine
- Les antagonistes des récepteurs AT1 de l’angiotensine (ARA)
Ces médicaments sont 10 000 fois plus sélectifs pour le récepteur AT1 que le récepteur AT2
Il s’agit d’inhibiteurs compétitifs, cependant leur antagonisme est souvent insurmontable (irréversible en présence d’angiotensine II) du fait de leur lente dissociation du récepteur. Ceci est un avantage en cas d’activation du système rénine angiotensine et permet une relative tolérance pour les oublis de dose.
Que révèle « the lancet », concernant les patients souffrant d’hypertension et de diabète sucré présentent-ils un risque accru d’infection à Covid-19 ?
Antihypertenseurs, Aras II (sartans)
Concernant les patients souffrant d’hypertension et de diabète sucré la revue« the Lancet » (lien 1) révèle que ces patients présentent un risque accru d’infection à Covid19.
- Il ressort d’une étude d'observation (2) rétrospective monocentrique portant sur 52 patients adultes gravement atteints de pneumonie SRAS-CoV-2 et admis en unité de soins intensifs de l'hôpital Wuhan Jin Yin-tan (Wuhan, Chine) entre fin Décembre 2019 et le 26 janvier 2020, que les comorbidités les plus distinctives des 32 non-survivants étaient des pathologies cérébro-vasculaires (22%) et un diabète (22%). Yang X- Yu Y-Xu J et al. Lancet Respir Med. 2020;( publié en ligne le 24 février ) https://doi.org/10.1016/S2213-2600(20)30079-5
Cette étude tenait compte des données démographiques, des symptômes, des valeurs de laboratoire, de toutes les comorbidités, des traitements et des résultats cliniques.
-
Une 2ème étude (3) incluant 1099 malades a confirmé 173 cas graves avec des comorbidités d'hypertension (23,7%), de diabète sucré (16,2%), de maladies coronariennes (5,8%) et des pathologies cérébro-vasculaires (3%). Guan W - Ni Z - Hu Y - et al. Caractéristiques cliniques de la maladie à coronavirus 2019 en Chine. N Engl J Med. 2020;( publié en ligne le 28 février ) DOI: 10.1056 / NEJMoa2002032
- Une troisième étude (4) portant sur 140 patients indique que 30% des malades souffraient d'hypertension et 12% de diabète. Zhang JJ - Dong X - Cao YY - et al. publié en ligne le 19 février 2020 ) DOI: 10.1111 / all.14238 Les liens utiles :
lien 1 "the lancet" https://www.thelancet.com/journals/lanres/article/PIIS2213-2600(20)30116-8/fulltext
lien 2 Etude d'observation https://www.thelancet.com/journals/lanres/article/PIIS2213-2600(20)30079-5/fulltext
lien 3 Une deuxième étude https://www.nejm.org/doi/10.1056/NEJMoa2002032
lien 4 Une troisième étude https://onlinelibrary.wiley.com/doi/full/10.1111/all.14238

Nous rappelons cependant que les coronavirus pathogènes humains se lient à leurs cellules cibles via l'enzyme de conversion de l'angiotensine 2 (ACE2),(lien 5)qui est exprimée
- par les cellules épithéliales du poumon, de l'intestin, du rein, et les vaisseaux sanguins. Wan Y - Shang J - Graham R - Baric RS - Li F Reconnaissance des récepteurs par un nouveau coronavirus de Wuhan: une analyse basée sur des études structurelles d'une durée de dix ans sur le SRAS. J Virologie. 2020;( publié en ligne le 29 janvier ) DOI: 10.1128 / JVI.00127-20
L'expression de l'ACE2 est considérablement augmentée chez les patients atteints de diabète de type 1 ou 2, traités avec des inhibiteurs de l'ECA et des bloqueurs des récepteurs de l'angiotensine II de type (ARA).
L'hypertension est également traitée avec des inhibiteurs de l'ECA et des ARA, ce qui entraîne une régulation positive de l'ACE2, laquelle peut également être augmentée par les thiazolidinediones et l'ibuprofène.
Ces données suggèrent que l'expression d'ACE2 est augmentée dans le diabète et le traitement avec cette classe thérapeutique ce qui faciliterait selon certaines études préliminaires mais non validées, l'infection par COVID-19.
Il est cependant admis une hypothèse selon laquelle les patients atteints de maladies cardiaques, d'hypertension ou de diabète, traités par des médicaments augmentant l'ECA2, pourraient courir un risque plus élevé d'infection grave.
Sur la base d'une recherche PubMed nous n'avons trouvé aucune preuve suggérant que les bloqueurs des canaux calciques antihypertenseurs augmentaient l'expression ou l'activité de l'ACE2, donc en cas de doute et à l’appréciation des traitants, les inhibiteurs calciques pourraient être un traitement alternatif approprié chez les malades symptomatiques au COVID-19.
Les liens de ce paragraphe :
lien 5 2 (ACE2) https://jvi.asm.org/content/94/7/e00127-20
Qu'en pense la Société Française de Pharmacologie et de Thérapeutique ?
Point sur l’état actuel (6) des connaissances entre système-rénine-angiotensine-aldostérone (SRAA), en particulier l’enzyme de conversion de l’angiotensine II (ACE2), puis entre médicaments bloqueurs du SRAA et COVID-19.
En résumé : Ces préoccupations théoriques entre ACE2, médicaments IEC/ARAII et le COVID-19 méritent des recherches beaucoup plus détaillées et dédiées. L’ACE2 pourrait être une porte d’entrée du COVID-19 et nous pouvons donc légitiment nous poser la question de cibler pharmacologiquement ACE2 (diminuer son expression tissulaire, en particulier pulmonaire ?) dans l’optique d’une prévention des infections à COVID-19 ou d’une diminution de la sévérité en cas d’infection déjà contractée.
A l’inverse, une fois l’infection contractée, favoriser la voie angiotensine ACE2/MasR par rapport à la voie angiotensine II/ACE/AT1R/aldostérone par une activation d’ACE2 et/ou une inhibition des effets de l’angiotensine II, pourrait représenter une cible pharmacologique et thérapeutique potentielle.
Toutes ces questions sont actuellement non résolues et sont étudiées scrupuleusement dans des essais cliniques en cours. Au fur et à mesure de l’évolution des recherches et des développements liés à cette question, des mises à jour de ces recommandations seront effectuées.
lien du paragraphe:
lien 6 Point sur l'état actuel https://www.elsevier.com/fr-fr/connect/medecine/ace2,-iecaraii-et-infections-a-covid-19
Découvrez l'ensemble des articles dans cette spécialité
-
COVID-19 - Les recommandations de la SFAR Stratégie pour la pratique de la chirurgie digestive et oncologique en situation d’épidémie de COVID 19
Les personnes souffrant d'hypertension sont-elles plus à risques ou est-ce un effet de leur traitement ?
D’après une étude (7) menée par des scientifiques de l'hôpital universitaire de Bâle, en Suisse, et de l'université de Thessalonique en Grèce, les personnes souffrant d’hypertension artérielle pourraient être plus à risque de présenter des symptômes graves ou mortels en cas d'infection au virus SARS-CoV-2, en raison de l'action de leurs médicaments.
Cette étude explique concrètement, que le virus adhérerait davantage aux cellules en les attaquant en se fixant sur une enzyme bien spécifique : l’enzyme de conversion de l'angiotensine.
Lien :
lien 7 étude https://www.thelancet.com/pdfs/journals/lanres/PIIS2213-2600(20)30116-8.pdf
A considérer : effets secondaires des IEC
La base de donnée publiques des médicaments (8) nous informe que les inhibiteurs de l’enzyme de conversion peuvent parfois provoquer une neutropénie, une agranulocytose, une thrombopénie, une anémie.
Certains patients peuvent présenter des infections sérieuses, qui, dans quelques cas, ne répondraient pas à une antibiothérapie intensive.
Les recommandations de l’ANSM (9) rappellent les précautions d’emploi et les règles de bon usage
Liens :
lien 8 la base de données publique des médicaments http://base-donnees-publique.medicaments.gouv.fr/affichageDoc.php?specid=63638906&typedoc=R
lien 9 les recommandations de l'ANSM https://ansm.sante.fr/S-informer/Points-d-information-Points-d-information/Medicaments-antihypertenseurs-agissant-sur-le-systeme-renine-angiotensine-rappels-des-precautions-d-emploi-et-des-regles-de-bon-usage-Point-d-information
Syndrome inflammatoire et emballement des cytokines
L’une des particularités du Covid-19, est dans une proportion notable de cas le déclenchement d’un « orage de cytokines » (on parle aussi de lymphohistiocytose hémophagocytaire secondaire), c’est-à-dire la libération massive de ces molécules impliquées dans l’activation et le contrôle de l’immunité. Il s’agit en quelque sorte d’une hyper-inflammation qui peut être fatale. La biologie des cytokines explique également, du moins en partie, le fait que nous ne sommes pas tous égaux face aux infections :
pour certains, le Covid-19 est bénin, pour d’autres, il prend des formes sévères.
Beaucoup de patients meurent plus d’une réponse immunitaire et inflammatoire incontrôlée que du virus lui-même.
Dans le cas de l’infection par COVID-19, ce phénomène inflammatoire pourrait être à l’origine de la plupart des décès en soins intensifs. Chez eux, l’emballement des cytokines entraîne un syndrome de détresse respiratoire et la défaillance de plusieurs organes.
Ce phénomène a déjà été observé pendant la pandémie de grippe de 1918 et plus récemment lors d'infections par le virus H5N1 de la grippe aviaire. Dans ces deux cas, les cytokines ont concerné les plus jeunes. La dégradation de leur état de santé a découlé d’une réaction immunitaire excessive à
l’infection.
Physiopathologie :
Les cytokines sont une famille de petites protéines sécrétées par les cellules et qui servent à la fois à la signalisation cellulaire et la communication entre cellules. Elles contrôlent la prolifération et la différenciation de nos cellules, mais aussi les réponses immunitaires et inflammatoires.
Le système immunitaire doit être capable de s'activer face à des antigènes étrangers, mais doit tolérer les antigènes du soi, c'est-à-dire les antigènes naturellement présents dans l'organisme. Lorsqu'un antigène est présenté dans un contexte naturel – non agressif –, il n'active pas les cellules immunitaires qui le reconnaissent, mais, au contraire, les désensibilise, les plaçant dans un état de somnolence, d'«anergie». Deux cytokines favorisent cette inactivation : le TGF bêta et l'interleukine 10. Selon les proportions respectives, sur le site de présentation de l'antigène, des cytokines stimulant les mécanismes immunitaires et favorisant l'inflammation ou, au contraire, des cytokines de la tolérance, le système immunitaire est activé ou mis au repos.
Ainsi, notre organisme tolère les bactéries du tractus digestif, ignorées par le système immunitaire. Klaus Rajewski et Werner Müller, de l'Université de Cologne, ont montré que, chez des souris dont le gène de l'interleukine 10 a été inactivé, une inflammation du tube digestif se développe rapidement. L'absence du facteur de tolérance déclenche une inflammation chronique face aux bactéries du tube digestif ; bien qu'elles ne soient pas pathogènes, le système immunitaire les reconnaît comme étrangères. De même, des souris dont le gène du TGF bêta a été inactivé in utero meurent peu après la naissance d'une inflammation diffuse, notamment cardio-pulmonaire
Outre les mécanismes de rétroaction qui contrôlent l'efficacité des réactions inflammatoires et les cytokines de la tolérance, un troisième mécanisme module les réactions immunitaires, les orientant vers des réactions de défense ou des réactions de type allergique. Dès l'étape de présentation des antigènes de l'agent pathogène, trois cytokines sont produites par les cellules présentatrices d'antigènes, l'interféron alpha, l'interleukine 12 et l'interleukine 18 (voir la figure 3). Les cellules présentatrices d'antigènes stimulent les lymphocytes T, et leur ordonnent de devenir des lymphocytes T auxiliaires de type 1, les lymphocytes Th1, producteurs d'interféron gamma. Les lymphocytes Th1 sont au cœur des réactions déclenchées par les virus, notamment. Les lymphocytes peuvent également devenir des lymphocytes Th2, qui, eux, produisent de l'interleukine 4, laquelle stimule la production des anticorps, et de l'interleukine 5, activant les polynucléaires éosinophiles. Les lymphocytes Th2 sont indispensables aux réactions de défense contre les parasites et participent aux réactions allergiques.
Comment le système immunitaire choisit-il entre les lymphocytes Th1, la voie des défenses contre les virus et contre les bactéries, ou les lymphocytes Th2, la voie de l'allergie?
Ce choix semble dépendre de la nature de l'intrus. Par exemple, certains parasites portent des antigènes capables d'orienter immédiatement la réaction lymphocytaire vers les lymphocytes Th2. Une fois cette réaction auxiliaire engagée dans un sens Th1 ou Th2, elle s'auto-amplifie ; la production de lymphocytes Th1 stimule la production de lymphocytes Th1 (de même pour les lymphocytes Th2), tandis que ces deux populations cellulaires s'inhibent réciproquement. Ces interactions sont contrôlées par les cytokines produites par les deux populations de lymphocytes T auxiliaires : l'interféron gamma, qui inhibe la production des lymphocytes Th2, et l'interleukine 4, qui inhibe celle des lymphocytes Th1.
Dans une tempête de cytokines, celles-ci sont, soit pro-inflammatoires, soit anti-inflammatoires. L'inflammation initialement locale se propage dans tout le corps par la circulation, y compris en l’absence de réplication du virus. Elles sont associées à des œdèmes, une diminution de la pression artérielle, une hémorragie et, finalement, la défaillance d’un ou plusieurs organes.
Les lésions pulmonaires aiguës sont la conséquence classique dans l'environnement alvéolaire des poumons et la circulation systémique ; elles sont le plus souvent associées à des infections touchant les poumons ou d'autres organes. Chez l'homme, elles se caractérisent par une réponse inflammatoire avec afflux de globules blancs suivie d’un dépôt progressif de collagène dans le poumon, qui constitue la fibrose.
Les lésions induites par des agents pathogènes peuvent évoluer vers une forme plus grave, le syndrome de détresse respiratoire aiguë (SDRA).

Angiotensine II, inflammation et arthérosclérose : (fig4)
De multiples données suggèrent que le système rénine-angiotensine contribue à la pathogenèse de l'athérosclérose. L'effet athérogène du système rénine-angiotensine ne s'explique qu'en partie par l'influence de son effecteur angiotensine II sur la tension artérielle, la croissance des cellules des muscles lisses (SMC) ou l'activité antifibrinolytique. Les données démontrent la capacité de l’angiotensine à provoquer une réponse inflammatoire dans les Cellule musculaire lisse vasculaires humaines par stimulation de la production de cytokines et activation de l'énergie nucléaire facteur-kB.
L’angiotensine II circulante peut interférer avec les éléments figurés du sang, en particulier avec les monocytes-macrophages. L’angiotensine II active les monocytes, mais également les polymorphonucléaires neutrophiles, via leur récepteurs AT-1. L’angiotensine II induit une dégranulation partielle des polymorphonucléaires neutrophiles, ainsi que la production d’ions superoxydes et la sécrétion de leucotriènes.
Un exemple de cet effet sur les leucocytes a été apporté par une étude menée chez des souris invalidées pour le gène de l’apolipoprotéine E (Apo E-/-), donc susceptibles à l’athérosclérose: la perfusion directe d’angiotensine II n’induit qu’une augmentation très limitée de la pression artérielle, mais provoque la formation d’anévrismes de l’aorte .
Ces derniers sont associés à une disparition des cellules musculaires lisses artérielles, à une destruction de la matrice extracellulaire et à une infiltration importante de cellules inflammatoires productrices de protéases (activateurs du plasminogène, métalloprotéinases) .

Un autre aspect physiopathologique vient d’être découvert grâce à une étude dernièrement publiée ayant utilisé la bioinformatique pour analyser le rôle de nouvelles protéines du coronavirus (telles que l'ORF8 et les glycoprotéines de surface). Lien :
Les résultats de l'étude montrent que l'ORF8 et les glycoprotéines de surface pourraient se combiner à la porphyrine pour former un complexe. En même temps, les protéines orf1ab, ORF10 et ORF3a pourraient coordonner et attaquer l'hème sur la chaîne 1-bêta de l'hémoglobine pour dissocier le fer de la porphyrine. L'attaque entraînera donc moins d'hémoglobine pour transporter l'oxygène et le dioxyde de carbone.
Les cellules pulmonaires présentant une inflammation extrêmement intense due à l'incapacité d'échanger du dioxyde de carbone et de l’oxygène, ce qui finit par aboutir à des images pulmonaires en verre dépoli relativement pathognomonique de l’infection Covid19. Les patients souffrant de détresse respiratoire seront aggravés.
Au fur et à mesure de l’augmentation des complexes porphyrine- virus produits dans le corps humain ils vont inhiber la voie anabolique de l'hème et provoquer une extension très large de l'infection. [12]
Traitement et prévention
La difficulté vient du fait qu’au cours d’une infection aiguë sévère, certains éléments de la réponse
immunitaire doivent être renforcés à certains moments et supprimés à d'autres. Au début de l'infection,
lorsqu’un virus se multiplie rapidement et que la charge infectieuse est élevée, certains traitements sont utiles, mais ils peuvent devenir néfastes quelques heures ou quelques jours plus tard, lorsque le système immunitaire ou les médicaments ont contenu l’infection, et qu’un orage de cytokine se développe.
Par exemple, on a beaucoup parlé des effets potentiellement indésirables des anti-inflammatoires au début d’une infection, en particulier parce qu’ils peuvent freiner la prolifération des lymphocytes. Mais des anti-inflammatoires ont été utilisés avec un certain succès pour augmenter la survie d’animaux infectés.
L’association de zanamvir, un inhibiteur de la neuraminidase du virus de la grippe, de célécoxib et de mésalazine, des anti-inflammatoires inhibiteurs de la cyclooxygénase-2 (anti-COX2), a augmenté la survie des souris infectées par une souche hautement pathogène du virus de la grippe H5N1. De même, les glucocorticoïdes sont déconseillés en cas d’infection parce qu’ils diminuent l’immunité ; mais des doses élevées permettraient d'atténuer une réponse immunitaire préjudiciable dans des situations désespérées.
Actuellement, les médicaments utilisés pour contenir les cytokines (10) visent à bloquer certains récepteurs à l’aide d’immunosuppresseurs prescrits en cas de maladies auto-immunes. Les premiers rapports venant de Chine évoquent des résultats favorables chez une série de patients COVID-19 gravement malades.
Pour ceux qui veulent comprendre le syndrome inflammatoire et de son emballement, voir le document de l’INSERM dans la rubrique « Pour aller plus loin » puis cet article du monde (11) qui évoque la responsabilité de cet emballement dans les troubles neurologiques consécutifs au Covid19.
Les liens utiles :
lien 10 les médicaments utilisés pour contenir les cytokines
https://pharmacomedicale.org/medicaments/par-specialites/item/cytokines-et-anti-cytokines-les-points-essentiels
lien 11 puis cet article du monde : https://www.lemonde.fr/blog/realitesbiomedicales/2020/04/07/covid-19-les-symptomes-peuvent-etre-neurologiques/
AINS IEC et ARA2 à considérer
Un quart des effets indésirables graves rapportés chez les utilisateurs d’antihypertenseurs correspondent à une association avec des anti-inflammatoires non stéroïdiens (aspirine, ibuprofène…) selon l’analyse des données françaises de pharmacovigilance réalisée par l’Unité Inserm 1027 de la Faculté de médecine de Toulouse. Ces effets délétères (12) concernent en priorité les bloqueurs du système rénine angiotensine aldostérone, IEC, ARA II et les diurétiques.
(source le quotidien du médecin)
Liens utiles :
Lien 12 ces effets délétères : https://www.lequotidiendumedecin.fr/archives/association-ains-et-antihypertenseurs-surveiller-de-pres
En conclusion
Apres cette revue de la littérature et des récentes études sur le Covid 19 , l’utilisation du récepteur ACE2 , l’interaction avec certaines classes thérapeutiques , l’analyse du rôle de nouvelles protéines du coronavirus ; l’orage cytokine il reste encore de nombreuses questions qui a notre sens doivent être élucidées :
►Le vrai lien entre COVID-19 et l’Enzyme de Conversion de l’Angiotensine 2
► la recherche d’autres alternatives thérapeutiques préventives permettant de diminuer la sévérité de l’infection au Covid 19en pensant Bloquer les récepteurs ACE2
► Une fois l’infection contractée , favoriser pharmacologiquement la voie angiotensine ACE2/MasR par rapport à la voie angiotensine II/ACE/AT1R/aldostérone par une activation d’ACE2 et/ou une inhibition des effets de l’angiotensine II.
► Les personnes souffrant d’hypertension sont plus à risque ou est-ce le traitement
► les effets secondaires des IEC en l’occurrence les agranulcytoses (neutropenie thrombopenie et anémie ) et leurs relation avec la sévérité de l’infection au covid19
►L’association avec des anti-inflammatoires non stéroïdiens (aspirine, ibuprofène…) et les IEC ET ARA2 est elle-même génératrice d’effets secondaires graves .
► Il est difficile de déterminer que l’augmentation de mortalité chez les hypertendus est liée à l’HTA, aux comorbidités associées ou aux traitements.
►Sous traitement par IEC ou Sartan, les études actuelles ne permettent aucune recommandation à ce stade. Il n’y a actuellement pas suffisamment d’évidence scientifique permettant de conclure que l’infection par Covid-19 est plus importante chez les patients sous IEC ou sartans.
► Dans une perspective plus globale peut on considérer le syndrome inflammatoire réactionnel à la pneumopathie, la chute de l’immunité, les AINS administrés conjointement aux IEC / ARA2 et les effets secondaires des Hypotenseurs comme une situation plus complexe ou s’interférent de nombreux facteurs et qu’il va falloir encore approcher.
En raison d’un manque de preuves solides,
En l’état actuel, et selon les recommandations du Comité Français de lutte contre l’hypertension et la Société Européenne de cardiologie les patients hypertendus sous sartan (ARA2) ou inhibiteur d’enzyme de conversion (IEC) présentant une infection par Covid-19 ou à risque d'infection, doivent garder le même traitement et donc ni l’arrêter, ni le modifier sans avis médical éclairé. A notre sens cette ligne de conduite nous parait sage mais n’est il pas possible de confirmer voir de proposer d’autres alternatives plus objectives.
Par conséquent, une des approches la plus rapide consiste à analyser les dossiers cliniques des patients et à appliquer les technologies de datamining pour déterminer si les patients sous antagonistes AT1R avant leur diagnostic ont eu de meilleurs résultats et une meilleure évolution.
Notre travail actuel relatant un certains nombre de faits et de données scientifiques, peut-être serait-il judicieux de tenter d’établir un lien de causes à effets entre les antihypertenseurs (IEC et ARA II ), les AINS , le syndrome inflammatoire ainsi que l’atteinte de l’hémoglobine et l’oxydation par le fer des poumons et une pathologie virale.
Si certains faits semblent évidents, le manque d’études ne permet pas validation.
L'UPGCS remercie le Docteur Mohamed Boutbaoucht et Elise Carboullec pour l'ensemble de leurs recherches sur ce sujet
Liens utiles :
lien 13 CFLHTA http://www.comitehta.org/actualites/covid-19-attention-a-ne-pas-stopper-les-antihypertenseur/
lien 14 ESC https://www.escardio.org/Councils/Council-on-Hypertension-(CHT)/News/position-statement-of-the-esc-council-on-hypertension-on-ace-inhibitors-and-ang
lien 15 : ici https://www.covid19-medicaments.com/
Pour aller plus loin :
- poumons et médicaments https://www.revmed.ch/RMS/2005/RMS-23/30474
Protocoles en cours actuellement :
- http://metaevidence.org/viewPathology2.aspx?exposition=508
- https://www.journalofhospitalinfection.com/article/S0195-6701(20)30046-3/fulltext
- persistance des virus sur surfaces inertes https://www.journalofhospitalinfection.com/article/S0195-6701(20)30046-3/fulltext#secsectitle0030 .
A lire aussi ci-dessous :
Base de données Elsevier qui analyse les données pour les professionnels de santé et des sciences. I (23)https://www.elsevier.com/fr-fr/search-results?query=coronavirus&labels=pages&page=1



Écrire commentaire
Dugué anne (jeudi, 16 avril 2020 16:38)
J'ai appelé mon médecin traitant pour échanger le Candesartan par un inhibiteur calcique . Elle ma dit qu'elle considérait que en temps de crise comme actuellement cela ne lui semblait pas judicieux , car pas certaine que ça se passe bien
Dois je laisser tomber ou appeler mon cardiologue ?
Anne Dugué